Alcool Méthylique / Methanol
L'alcool méthylique ou méthanol est un alcool de bois utilisé comme solvant dans de nombreux domaines. Il sert également d'antigel dans les lave-glaces et de dénaturant dans l'éthanol.
Expédition
Dans toute l'Europe
Paiement sécurisé
CB, Virement, Paypal ...
Information logistique
L'expédition de ce produit* s'effectue exclusivement via messagerie. De ce fait, la livraison de votre commande n'est possible qu'en journée.
* En raison de contraintes logistiques / douanières / sécuritaires totalement indépendantes de notre volonté.
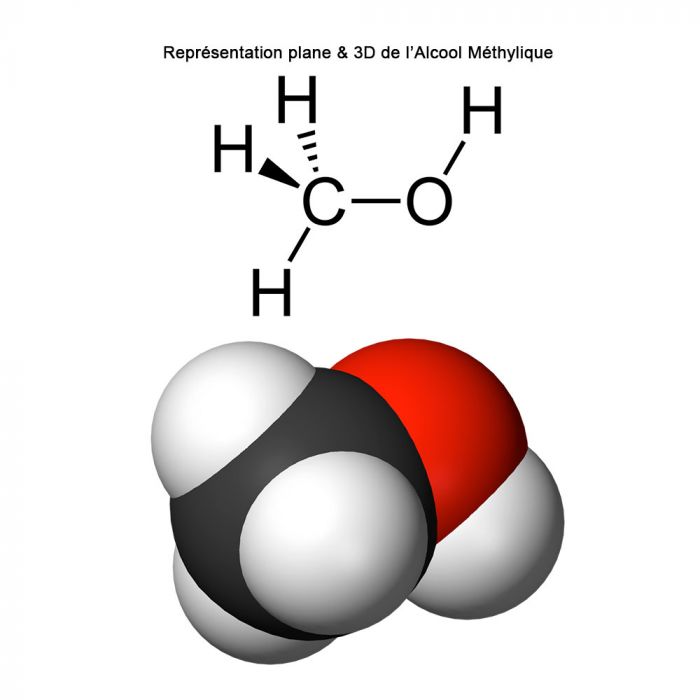
L'Alcool Méthylique est un composé chimique de formule CH3OH. C'est un solvant organique et l'alcool aliphatique le plus simple.
C'est un liquide léger, volatil, incolore et inflammable avec une odeur alcoolique distinctive semblable à celle de l'éthanol (alcool potable). Le méthanol a acquis le nom d'Alcool de Bois parce qu'il était autrefois produit principalement par la distillation destructrice du bois.
En effet, dans leur processus d'embaumement , les anciens Égyptiens utilisaient un mélange de substances, dont du méthanol, qu'ils obtenaient par pyrolyse du bois. Le méthanol pur, cependant, a été isolé pour la première fois en 1661 par Robert Boyle, lorsqu'il le produisait via la distillation du buis. Il est devenu plus tard connu sous le nom d'« Esprit Pyroxylique ». En 1834, les chimistes français Jean-Baptiste Dumas et Eugène Peligot déterminèrent sa composition élémentaire.
Le chimiste français Paul Sabatier a présenté le premier procédé pouvant être utilisé pour produire du méthanol de manière synthétique en 1905. Ce procédé suggérait que le dioxyde de carbone et l'hydrogène pouvaient réagir pour produire du méthanol. Les chimistes allemands Alwin Mittasch et Mathias Pier, travaillant pour Badische-Anilin & Soda-Fabrik (BASF), ont développé un moyen de convertir le gaz de synthèse (un mélange de monoxyde de carbone, de dioxyde de carbone et d'hydrogène) en méthanol et ont obtenu un brevet.
Aujourd'hui, le méthanol est principalement produit industriellement par hydrogénation du monoxyde de carbone.
Le Méthanol est constitué d'un groupe méthyle lié à un groupe hydroxyle polaire (souvent abrégé en MeOH). Avec plus de 20 millions de tonnes produites chaque année, il est utilisé comme précurseur d'autres produits chimiques de base, notamment le formaldéhyde, l'acide acétique, l'éther méthyltert-butylique, le benzoate de méthyle, l'anisole, les peroxyacides, ainsi qu'une foule d'autres produits chimiques.
PRINCIPALES UTILISATIONS
- Le méthanol est utilisé traditionnellement comme dénaturant de l'Ethanol, ce qui explique l’origine du terme alcool dénaturé.
- Le méthanol est également utilisé comme solvant, et comme antigel dans les oléoducs et le liquide des lave-glaces.
- Dans certaines stations d'épuration, une petite quantité de méthanol est ajoutée aux eaux usées pour leur fournir une source de carbone afin d’alimenter les bactéries dénitrifiantes, qui transforment les nitrates en azote.
- Les piles à combustibles fonctionnant au méthanol sont les seules qui soient utilisables à basse température, à basse pression, ce qui permet leur miniaturisation à un niveau jusqu’alors inconnu.
CARACTÉRISTIQUES
- Formule brute : CH3OH
- Origine : Egypte
- Pureté : >= 99,85%
- Numéro CE : 200-659-6
- Numéro Cas : 67-56-1
- Numéro UN : 1230
- Qualité : technique
SYNONYMES (LISTE NON EXHAUSTIVE)
Méthanol, carbinol, alcool de bois, naphte de bois, esprit de bois.
CONSEILS D'EMPLOI
Pour réaliser une expérience de combustion colorée
- Matériel nécessaire :
- Méthanol (alcool méthylique)
- Différents sels de métaux (chlorures de cuivre, de sodium, de potassium, de lithium, etc.)
- Échantillons de fil de coton non traité
- Pince à épiler
- Plaque de combustion résistante à la chaleur
- Allumette ou briquet
- Lunettes de protection
- Étapes :
-
- Portez des lunettes de protection pour assurer votre sécurité.
- Préparez de petites quantités de sels de métaux différents sur la plaque de combustion.
- Trempez les extrémités des échantillons de fil de coton dans les différents sels de métaux. Assurez-vous que les fils absorbent bien les sels.
- Laissez les fils de coton imprégnés de sels sécher à l'air pendant quelques minutes.
- Placez les fils de coton imprégnés de sels sur la plaque de combustion, en veillant à ne pas les toucher directement avec vos mains (utilisez une pince à épiler).
- Versez un peu de méthanol sur les fils de coton pour les humidifier.
- Éloignez-vous de la plaque de combustion, allumez une allumette ou un briquet et approchez-le doucement des fils de coton humidifiés avec du méthanol.
- Observations :
Vous observerez que chaque sel de métal produit une flamme de couleur différente lorsque le méthanol brûle. Les couleurs peuvent varier en fonction du métal présent dans le sel :
-
- Sodium : Jaune orangé
- Potassium : Violet
- Lithium : Rouge vif
- Cuivre : Vert
- Strontium : Rouge écarlate
- Baryum : Vert pâle
- Explications :
Les couleurs observées dans cette expérience sont dues à la présence d'électrons excités dans les atomes des métaux. Lorsque le méthanol brûle, il produit une flamme chaude. Lorsque les sels de métaux sont chauffés dans la flamme, les électrons des atomes absorbent de l'énergie et se déplacent vers des niveaux d'énergie supérieurs. Lorsque ces électrons retournent à leur niveau d'énergie initial, ils émettent de la lumière visible sous forme de couleurs caractéristiques de chaque métal.
Cette expérience met en évidence les propriétés spectaculaires des métaux et de leurs sels, tout en illustrant les principes de base de l'excitation et de l'émission de lumière. N'oubliez pas de la réaliser avec précaution et dans un environnement sûr.
- Le produit est très inflammable. Eviter la chaleur, les flammes et toute autre source d'inflammation. Prévenir l'électricité statique et la formation d'étincelles.
- Matières incompatibles : les acides forts, les oxydants puissants et les bases fortes.
- Produits de décomposition dangereux : Une décomposition thermique ou un brûlage peut libérer des oxydes de carbone et d'autres gaz ou vapeurs toxiques.
| Pictogramme(s) |    Danger Danger |
| Phrase(s) de Risque |
H225 : Liquide et vapeurs très inflammables |
| Conseil(s) de Sécurité |
P210 : Tenir à l'écart de la chaleur/étincelles/flammes/surfaces chaudes. Ne pas fumer |
| Pays de fabrication | Égypte |
|---|---|
| Numéro CE | 200-659-6 |
| Numéro Cas | 67-56-1 |
| Numéro UN | 1230 |
| Code Douanier | 29051100 |
Chimiques
| Caractéristiques | Spécifications |
| Pureté | ≥ 99,85% |
| Acetone | Max 30 mg/kg |
| Ethanol | Max 50 mg/kg |
| Eau | Max 0.1% w/w |
| Chlorures (as Cl-) | Max 0.5 mg/kg |
| Soufre | Max 0.5 mg/kg |
| Substances carbonisables | Max 30 |
| Acidité (as acide acétique) | Max 30 mg/kg |
| Fer en solution | Max 0.1 mg/kg |
| Matières non volatiles | Max 8 mg/1000ml |
Physiques
| Caractéristiques | Spécifications |
| Aspect | Liquide limpide et incolore |
| Couleur | Max 5 |
| Odeur | Alcool aromatique |
| Point de fusion | -97,8°C |
| Point d'ébullition | 64,5°C |
| Point éclair | 11°C |
| Température d'auto-inflammabilité | 385°C |
| Danger d'explosion | Le produit n'est pas explosif. Toutefois, des mélanges explosifs vapeur-air peuvent se former |
| Densité à 20 °C | 0,792 à 20°C |
| Solubilité dans/miscibilité avec | Eau : soluble Chloroforme, éthanol, acétone, ether : soluble |
| Coefficient de partage (n-octanol/eau) | -0,82 / -0,66 log Pow |
| Viscosité | 0.0006 Pa s |